








《《氧化还原反应》高中化学PPT课件》是由用户上传到老师板报网,本为文库资料,大小为1.31 MB,总共有37页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 37页
- 1.31 MB
- VIP模板
- pptx
- 数字产品不支持退货
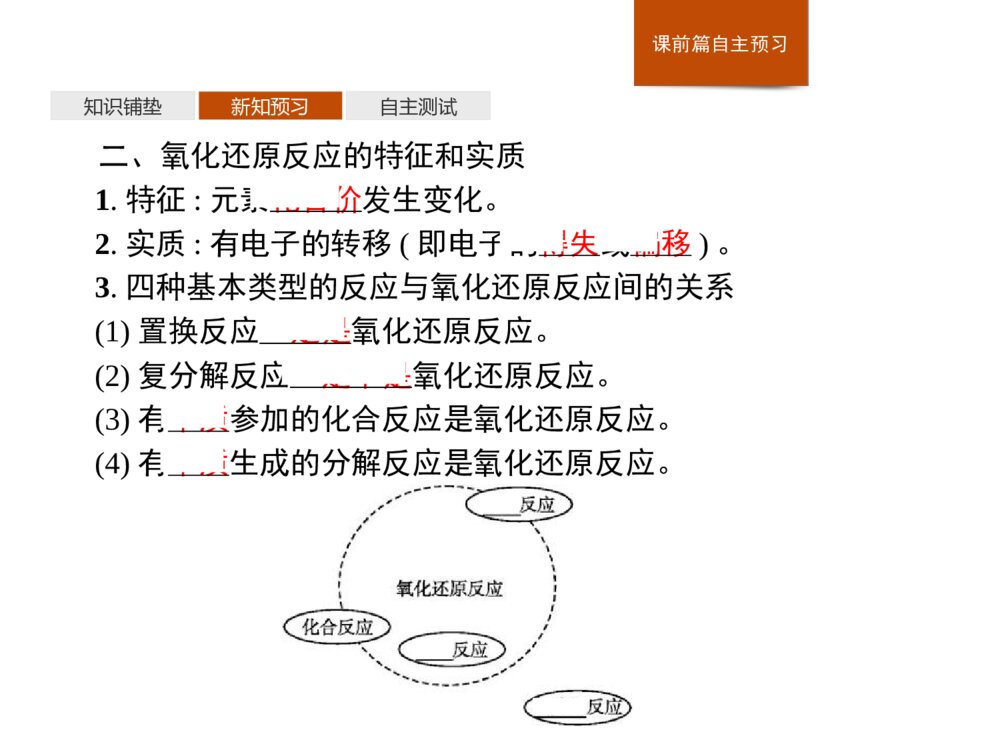
-1-第三节 氧化还原反应1.通过氧化反应、还原反应的相关概念和实质的学习,体现宏观辨识与微观探析的核心素养。2.通过对氧化还原反应的特征——元素化合价的升降的理解,体会氧化还原反应的实质——电子的转移,培养变化观念与平衡思想。3.通过对氧化还原反应中电子转移表示方法的分析,理解模型认知的核心素养。1.通过氧化反应、还原反应的相关概念和实质的学习,体现宏观辨识与微观探析的核心素养。2.通过对氧化还原反应的特征——元素化合价的升降的理解,体会氧化还原反应的实质——电子的转移,培养变化观念与平衡思想。3.通过对氧化还原反应中电子转移表示方法的分析,理解模型认知的核心素养。课前篇自主预习知识铺垫新知预习自主测试1.物质得到氧的反应叫氧化反应,物质失去氧的反应叫还原反应,一种物质被氧化,同时另一种物质被还原的反应称为氧化还原反应。2.在反应CuO+H2Cu+H2O中,H2被CuO氧化生成H2O,CuO被H2还原生成Cu。3.在反应Fe+CuSO4=FeSO4+Cu中,Fe元素的化合价从0价升高到+2价,Cu元素的化合价从+2价降低到0价。4.在物质H2O、CaH2中,氢元素的化合价分别是+1价、-1价;在物质H2O、H2O2中,氧元素的化合价分别是-2价、-1价。课前篇自主预习知识铺垫新知预习自主测试一、从不同角度分析氧化还原反应1.从得氧、失氧的角度认识氧化还原反应反应:2CuO+C2Cu+CO2↑(1)CuO失氧,发生了还原反应,该物质是氧化剂。(2)C得氧,发生了氧化反应,该物质是还原剂。结论:从得氧、失氧的角度看,一种物质得到氧被氧化,另一种物质失去氧被还原的反应叫做氧化还原反应。课前篇自主预习知识铺垫新知预习自主测试2.从元素化合价变化的角度认识氧化还原反应(1)反应:Fe2O3+3CO2Fe+3CO2①铁元素化合价降低,Fe2O3失氧,发生还原反应,被还原。②碳元素化合价升高,CO得氧,发生氧化反应,被氧化。(2)反应:Fe+CuSO4=FeSO4+Cu(反应中没有物质得氧、失氧)①Fe元素化合价升高,Fe发生氧化反应,被氧化。②Cu元素化合价降低,CuSO4发生还原反应,被还原。结论:从反应前后元素化合价变化的角度看,只要反应前后有元素化合价变化的反应,就叫做氧化还原反应。课前篇自主预习知识铺垫新知预习自主测试3.从电子转移的角度认识氧化还原反应(1)对于反应2Na+Cl22NaCl:①氯元素化合价降低,氯原子得电子,Cl2发生还原反应,被还原。②钠元素化合价升高,钠原子失电子,Na发生氧化反应,被氧化。(2)反应:H2+Cl22HCl①氯元素化合价降低,共用电子对偏向氯原子,Cl2发生还原反应,被还原。②氢元素化合价升高,共用电子对偏离氢原子,H2发生氧化反应,被氧化。结论:从电子转移的角度看,化学反应中凡有电子转移的反应叫做氧化还原反应。课前篇自主预习知识铺垫新知预习自主测试二、氧化还原反应的特征和实质1.特征:元素化合价发生变化。2.实质:有电子的转移(即电子的得失或偏移)。3.四种基本类型的反应与氧化还原反应间的关系(1)置换反应一定是氧化还原反应。(2)复分解反应一定不是氧化还原反应。(3)有单质参加的化合反应是氧化还原反应。(4)有单质生成的分解反应是氧化还原反应。课前篇自主预习知识铺垫新知预习自主测试【微思考】有单质参加的反应或有单质生成的反应一定属于氧化还原反应吗?提示不一定。如在放电条件下,O2可变为O3,化学方程式为3O22O3,该反应中无元素化合价的改变,则该反应不属于氧化还原反应。课前篇自主预习知识铺垫新知预习自主测试1.判断正误(正确的打“√”,错误的打“×”)。(1)有物质得氧、失氧的反应才是氧化还原反应。()(2)在HNO3、N2O4、NaNO2、NO、N2和NH4Cl中氮元素的化合价分别为+5价、+4价、+3价、+2价、0价和-3价。()(3)在氧化还原反应中,可能只有元素的化合价的升高,而无元素化合价的降低。()(4)没有单质参加的反应一定不是氧化还原反应。()(5)某元素由化合态变为游离态,该元素一定被还原。()答案(1)× (2)√ (3)× (4)× (5)×课前篇自主预习知识铺垫新知预习自主测试2.已知反应:①SO3+H2O=H2SO4②Cl2+H2O=HCl+HClO③2F2+2H2O=4HF+O2④2Na+2H2O=2NaOH+H2↑⑤Na2O+2HCl=2NaCl+H2O(1)上述反应中不属于氧化还原反应的有 (填序号,下同)。H2O被氧化的是 ,H2O被还原的是。属于氧化还原反应,但其中的H2O既不被氧化又不被还原的是 。(2)写出反应④的离子方程式: 。答案(1)①⑤ ③ ④ ②(2)2Na+2H2O=2Na++2OH-+H2↑课堂篇探究学习探究一探究二素养脉络随堂检测氧化还原反应的有关概念及联系问题探究思考探究下列有关问题:1.CO2+2NaOH=Na2CO3+H2O和CO+CuOCu+CO2两反应,哪一个反应是氧化还原反应?判断依据是什么?提示后者是氧化还原反应,判断依据是该反应中C、Cu的化合价发生变化。2.反应Zn+H2SO4=ZnSO4+H2↑中,什么元素被氧化?哪种物质发生还原反应?提示Zn元素被氧化,H2SO4发生还原反应。课堂篇探究学习探究一探究二素养脉络随堂检测3.在反应2KClO32KCl+3O2↑中,哪种元素被还原?哪种物质发生氧化反应?提示Cl元素被还原,KClO3发生氧化反应。4.如果氧化反应生成氧化产物,还原反应生成还原产物,则反应MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O中的氧化产物和还原产物分别是什么物质?提示氧化产物是Cl2,还原产物是MnCl2。课堂篇探究学习探究一探究二素养脉络随堂检测深化拓展1.对氧化反应、还原反应、氧化还原反应概念的比较狭义含义特征本质氧化反应物质得到氧的反应元素化合价升高的反应失去电子(或电子对偏离)的反应还原反应物质失去氧的反应元素化合价降低的反应得到电子(或电子对偏向)的反应氧化还原反应有物质得氧、失氧的反应有元素化合价升降的反应有电子转移(得失或偏移)的反应狭义含义特征本质氧化反应物质得到氧的反应元素化合价升高的反应失去电子(或电子对偏离)的反应还原反应物质失去氧的反应元素化合价降低的反应得到电子(或电子对偏向)的反应氧化还原反应有物质得氧、失氧的反应有元素化合价升降的反应有电子转移(得失或偏移)的反应课堂篇探究学习探究一探究二素养脉络随堂检测2.氧化还原反应中的几个“不一定”(1)一种元素被氧化,不一定有另一种元素被还原。如反应Cl20+H2OHCl-1+HCl+1O中,被氧化和被还原的元素都是氯元素。(2)一种反应物不一定只表现出一种性质。如反应2KMnO4K2MnO4+MnO2+O2↑中,参加反应的KMnO4既表现了还原性,又表现了氧化性。(3)有单质参加或生成的反应不一定是氧化还原反应。如同素异形体之间的相互转化不属于氧化还原反应。(4)某种物质由化合态变为游离态,不一定是被还原,如HCl→Cl2就是HCl被氧化。(1)一种元素被氧化,不一定有另一种元素被还原。如反应Cl20+H2OHCl-1+HCl+1O中,被氧化和被还原的元素都是氯元素。(2)一种反应物不一定只表现出一种性质。如反应2KMnO4K2MnO4+MnO2+O2↑中,参加反应的KMnO4既表现了还原性,又表现了氧化性。课堂篇探究学习探究一探究二素养脉络随堂检测素能应用典例1下列反应中,画线的物质发生氧化反应的是()A.Cu+2FeCl32FeCl2+CuCl2B.CO2+C2COC.Fe2O3+2AlAl2O3+2FeD.CO2+NaOHNaHCO3答案C解析A项FeCl3中的Fe元素、B项CO2中的C元素的化合价都是降低的,所以FeCl3和CO2都发生还原反应;C项Al→Al2O3,Al元素化合价升高,发生氧化反应;D项不是氧化还原反应。A.Cu+2FeCl32FeCl2+CuCl2B.CO2+C2COC.Fe2O3+2AlAl2O3+2FeD.CO2+NaOHNaHCO3课堂篇探究学习探究一探究二素养脉络随堂检测温馨提示对于化合物中元素化合价的确定,需要注意以下几点:(1)化合价有正价和负价之分。①氧元素通常显-2价。②氢元素通常显+1价。③金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价。④一些元素在不同物质中可显不同的化合价。(2)在化合物中,各元素正、负化合价的代数和为0。(3)元素的化合价是元素的原子在形成化合物时表现出来的一种性质,因此,单质中元素的化合价为0。课堂篇探究学习探究一探究二素养脉络随堂检测变式训练1下列关于氧化还原反应的说法错误的是( )A.在反应中失去电子的物质被氧化,得到电子的物质被还原B.在氧化还原反应中氧化产物和还原产物可以是同一种物质C.氧化还原反应是一种物质首先被氧化,另一种物质再被还原的反应D.只有氧化没有还原的反应是不存在的答案C解析在一个氧化还原反应中,氧化反应和还原反应是同时发生的,二者既是对立的,又是统一的。课堂篇探究学习探究一探究二素养脉络随堂检测氧化还原反应中电子转移的表示方法问题探究1.下列箭头前后标明的是反应物和对应的生成物,请指出转移的电子数。①MnO2→MnCl2 ②2Cl-→Cl2 ③Al2O3→2Al提示①2e- ②2e- ③6e-课堂篇探究学习探究一探究二素养脉络随堂检测2.实例分析氧化还原反应中电子转移的表示方法。(1)方法1:双线桥法①H2+CuOCu+H2O②2H2O22H2O+O2↑(2)方法2:单线桥法①3Cl2+2Fe2FeCl3②MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O①H2+CuOCu+H2O②2H2O22H2O+O2↑(2)方法2:单线桥法①3Cl2+2Fe2FeCl3②MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O课堂篇探究学习探究一探究二素养脉络随堂检测提示(1)①②(2)①②提示(1)①②(2)①②课堂篇探究学习探究一探究二素养脉络随堂检测深化拓展1.双线桥法和单线桥法的书写步骤(1)双线桥法的书写步骤:课堂篇探究学习探究一探究二素养脉络随堂检测(2)单线桥法的书写步骤:课堂篇探究学习探究一探究二素养脉络随堂检测2.用双线桥法表示电子转移的方向和数目时的注意事项(1)箭头必须由反应物指向生成物,且两端对准同种元素。(2)在“线桥”上标明电子“得到”或“失去”,且得到与失去的电子总数必须相等,电子对的偏移也按得失处理。(3)电子转移数以a×be-形式表示,a表示发生氧化还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略。(4)箭头方向不代表电子转移的方向,仅表示电子转移前后粒子的变化。3.用单线桥法表示电子转移的方向和数目时的注意事项(1)单线桥必须画在反应物中。(2)箭头指向得电子原子,箭尾指向失电子原子。(3)“线桥”上只标电子转移的数目,不标“得”“失”字样。课堂篇探究学习探究一探究二素养脉络随堂检测素能应用典例2已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(1)被氧化的元素是 ,被还原的元素是 ,发生氧化反应的物质是 ,发生还原反应的物质是 。(2)用双线桥法表示反应中电子转移的方向和数目。(3)用单线桥法表示反应中电子转移的方向和数目。课堂篇探究学习探究一探究二素养脉络随堂检测答案(1)Cu N Cu HNO3(2)(3)解析由化学方程式可知:铜元素化合价升高,从0价变为+2价,被氧化;氮元素化合价降低,从+5价变为+2价,被还原;故Cu发生氧化反应,HNO3发生还原反应。(2)(3)课堂篇探究学习探究一探究二素养脉络随堂检测温馨提示(1)常见元素的主要化合价氟氯溴碘负一价,正一氢银与钾钠。氧的负二先记清,正二镁钙钡和锌。正三是铝正四硅,下面再把变价归。全部金属是正价,一二铜来二三铁。锰正二四与六七,碳的二四要牢记。非金属负主正不齐,氯的负一正一五七。氮磷负三与正五,不同磷三氮二四。硫有负二正四六,边记边用就会熟。(2)常见根价口诀一价铵根硝酸根,氢卤酸根氢氧根。高锰酸根氯酸根,高氯酸根醋酸根。二价硫酸碳酸根,氢硫酸根锰酸根。暂记铵根为正价,负三有个磷酸根。课堂篇探究学习探究一探究二素养脉络随堂检测变式训练2下列化学方程式中,表示电子转移的方向和数目都正确的是( )A.B.C.D.A.B.C.D.课堂篇探究学习探究一探究二素养脉络随堂检测答案B解析A项,KClO3中氯元素的化合价由+5价降到0价,不能与HCl中氯元素的-1价“错位”,正确的表示方法为;C项,CO中的碳元素由+2价升到+4价,转移2e-,由于反应中CO的化学计量数为2,故正确的表示方法应为;;;课堂篇探究学习探究一探究二素养脉络随堂检测D项,HgS中汞元素由+2价降到0价,转移2e-,O2中氧元素由0价降到-2价,转移2×2e-,且均为得电子,而HgS中硫元素化合价由-2价升高到+4价,失6e-,正确的表示方法为。。课堂篇探究学习探究一探究二素养脉络随堂检测课堂篇探究学习探究一探究二素养脉络随堂检测1.古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )A.野火烧不尽,春风吹又生B.春蚕到死丝方尽,蜡炬成灰泪始干C.粉身碎骨浑不怕,要留清白在人间D.爆竹声中一岁除,春风送暖入屠苏答案C解析A、B两项中均涉及物质燃烧,D项中有火药爆炸,都属于氧化还原反应;C项中反应为CaCO3CaO+CO2↑,无元素化合价升降,属于非氧化还原反应。课堂篇探究学习探究一探究二素养脉络随堂检测2.下列关于氧化还原反应的叙述正确的是( )A.H2还原CuO的反应只属于还原反应B.置换反应都是氧化还原反应,3CO+Fe2O32Fe+3CO2既是置换反应又是氧化还原反应C.3O22O3是氧化还原反应D.复分解反应一定不是氧化还原反应答案D课堂篇探究学习探究一探究二素养脉络随堂检测解析A项,氧化还原反应是一个整体,氧化反应和还原反应必然同时存在于同一个反应中,在H2+CuOCu+H2O过程中,CuO失去氧被还原,发生了还原反应,H2得到氧被氧化,发生了氧化反应;置换反应都是氧化还原反应,但CO与Fe2O3的反应不是置换反应,所以B项错;C项中反应前后氧元素的化合价没有变化,属于非氧化还原反应;D项,复分解反应是两种化合物互相交换成分重新组合成新的化合物的过程,没有电子转移,所以,复分解反应一定不是氧化还原反应。课堂篇探究学习探究一探究二素养脉络随堂检测3.某反应中,X元素的原子将电子转移给Y元素的原子,则下列说法正确的是( )①元素X被氧化 ②元素Y被氧化 ③元素X发生还原反应 ④元素Y发生还原反应A.①②B.③④C.②③D.①④答案D解析根据题意知,X元素的原子失去电子,X元素化合价升高,发生氧化反应;而Y元素的原子获得电子,Y元素化合价降低,发生还原反应。课堂篇探究学习探究一探究二素养脉络随堂检测4.氧化还原反应发生在同种元素之间的是( )A.Zn+2HClZnCl2+H2↑B.2H2S+SO23S+2H2OC.H2+CuOCu+H2OD.2H2O2H2↑+O2↑答案B解析通过准确判断化合物中元素化合价的变化,可快速解答此题。A.Zn+2HClZnCl2+H2↑B.2H2S+SO23S+2H2OC.H2+CuOCu+H2OD.2H2O2H2↑+O2↑课堂篇探究学习探究一探究二素养脉络随堂检测5.(1)分析下列反应的化学方程式,是氧化还原反应的用双线桥法标出电子转移的方向和数目,并指出被氧化和被还原的元素。①2Na+Cl22NaCl②NaOH+HClNaCl+H2O(2)分析下列反应的化学方程式,是氧化还原反应的用单线桥法标出电子转移的方向和数目。①BaCl2+Na2SO4BaSO4↓+2NaCl②Fe+2HClFeCl2+H2↑①2Na+Cl22NaCl②NaOH+HClNaCl+H2O①BaCl2+Na2SO4BaSO4↓+2NaCl②Fe+2HClFeCl2+H2↑课堂篇探究学习探究一探究二素养脉络随堂检测答案(1)①②非氧化还原反应(2)①非氧化还原反应②解析首先分析各个反应中元素化合价的变化,化合价升高的元素失去电子被氧化,化合价降低的元素得到电子被还原;用箭头标出电子转移的方向和数目时,要注意单、双线桥表示方法的特点及各自的注意事项。 答案(1)①②



















